Una mayor cantidad de pacientes con artritis reumatoide en todo el país se benefician hoy con los efectos inmunomoduladores y antinflamatorios del medicamento Jusvinza, que se encuentra en la fase III de su ensayo clínico.
Tras comenzar su primera parte antes de la llegada de la COVID-19, y recibir este mes de septiembre el registro sanitario de la autoridad regulatoria, la presente etapa del estudio abarca también la región oriental de Cuba, informó el diario Granma.
El reumatólogo Raúl Cepero Morales destacó que los pacientes incluidos en el ensayo han mejorado su calidad de vida gracias a los efectos inmunomoduladores y antinflamatorios de Jusvinza, producto desarrollado por el Centro de Ingeniería Genética y Biotecnología.
También señaló que no se han registrado efectos adversos en las primeras cuatro dosis, por lo que en ningún caso ha sido necesario suspender la administración de esta costosa terapia.
Camagüey, con 212 voluntarios, es la provincia que más ha logrado incluir en la tercera fase. Los primeros recibieron esta semana la cuarta dosis, que completa el primer mes del tratamiento, quienes desde ahora y hasta los seis meses recibirán una dosis mensual, precisó el especialista.
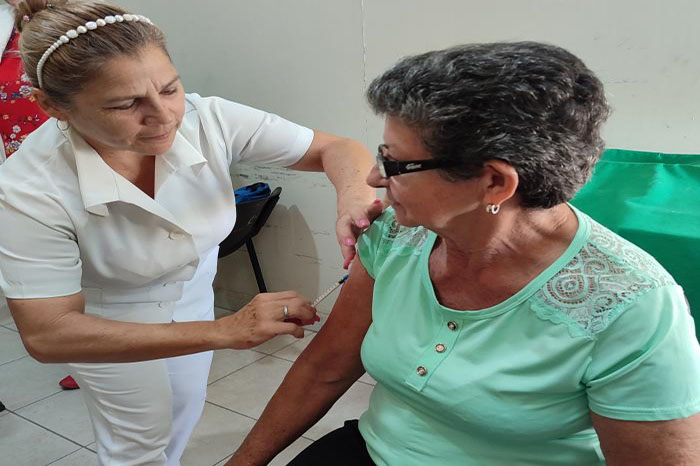
La paciente Ana Magalis Gil Rodríguez ya recibió su cuarta dosis, y declaró que se siente un poco más aliviada y desinflamada.
Al autorizar el empleo de Jusvinza en el tratamiento de la artritis reumatoide, el Centro Estatal para el Control de Medicamentos y Dispositivos Médicos refirió que, luego de un riguroso proceso de evaluación de las evidencias presentadas, el medicamento demostró calidad, seguridad y eficacia para la indicación propuesta.
Durante el enfrentamiento a la COVID-19, este péptido sintético recibió un Autorizo de Uso de Emergencia para el tratamiento de pacientes graves y críticos de esa enfermedad, debido a su mecanismo de acción y propiedades farmacológicas.
nyr/ACN



0 Comentarios
Con su comentario usted colabora en la gestión de contenidos y a mejorar nuestro trabajo